從病人血液中進行循環腫瘤細胞(Circulating tumor cells, CTCs)的分離與分析,可以實現非侵入性的“液體活檢”(Liquid biopsy),這對於癌症的早期診斷和預後評估具有非常重要的臨床診斷價值。CTCs是從實體瘤脫落,發生上皮—間質轉化進入到血液循環的惡性腫瘤細胞。由於外周血中CTCs數量稀少(十億個血細胞中僅含有1~10個CTCs),且具有高度異質性和易聚集成團等特點,因而CTCs研究的關鍵在於從含有大量血細胞的複雜血液樣本中準確地將其分離出來,且要滿足高純度、高捕獲率和高通量三個要求。
作為目前唯一通過FDA認證的CTCs分離與計數係統,CellSearch,是採用外麵包被了特異性抗體抗EpCAM(上皮細胞粘附因子)的免疫磁珠,通過抗原抗體作用,與血液中表達EpCAM的CTCs結合,並進一步通過熒光反應識別。雖然該技術有較高的靈敏度,但其仍存在著一些缺點,如未實現全自動分選、假陽性比率高、預處理環節損失大量目標細胞,以及富集後的CTCs沒有生物活性等。
日前,來自於多倫多大學的Edward Sargent教授與Shana Kelley教授共同合作,發明了一種基於微流控芯片的被稱為MagRC(Magnetic ranking cytometry)的技術,能夠區分出全血細胞中的CTCs,並對異質性的CTCs進行分類。該技術的靈敏度能達到單個細胞的檢測,且能追踪腫瘤生長程度不同的小鼠內CTCs表面的動態顯型。這種方法與市場上的黃金標準結果相一致,但需要的細胞數量更少,且不受大量血細胞的影響。相關研究成果已發表於Nature Nanotechnology雜誌上。
研究人員所發明的MagRC技術是利用免疫磁性分離法,依據CTCs表面標記物的表達量來進行分類。他們首先將血液樣品與抗體修飾的磁性納米粒子相孵育,使CTCs表面特異性地結合上磁性納米粒子。CTCs表面標誌物表達量越多,結合的納米粒子也就越多。接著,將樣品注入到微流控裝置中,該裝置內從左到右有不同半徑的微型磁體,以此產生一個磁場梯度。結合有較多納米粒子的CTCs在低磁場強度的區域內即可被捕獲,而結合較少納米粒子的CTCs會在高磁場強度的區域內被捕獲,再通過免疫熒光使捕獲的CTCs可視化,最終實現對CTCs的分類。
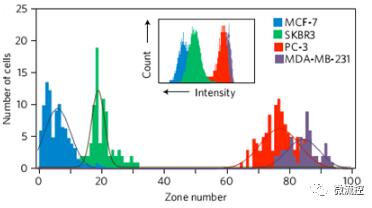
四種不同標誌物表達的細胞在芯片上的分佈
首先,研究人員利用MagRC技術對四種已知的標記物表達量不同的細胞進行了檢測,證實該技術能準確且靈敏地將四種細胞進行分類。
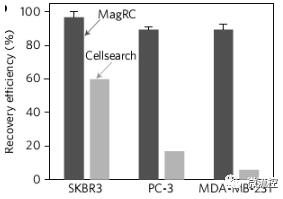
MagRC技術與商業化的CellRearch技術相對比
研究人員接著利用此技術對未經處理的全血中的癌細胞進行檢測,並與商業化的CellRearch技術相比較。結果發現,MagRC技術在全血樣品中依然保持有較高靈敏度,相比而言,CellRearch的效率在檢測低表達量標誌物的癌細胞時會受到極大的影響。
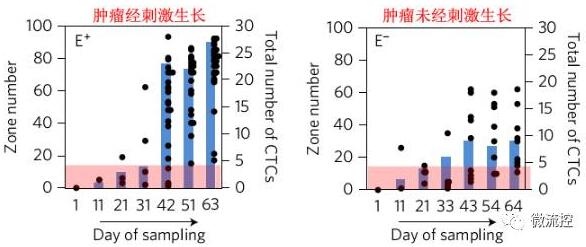
MagRC技術用於追踪CTCs的動態顯型
為了將MagRC技術應用到追踪CTCs動態顯型中,研究人員採用兩種荷瘤小鼠模型,即腫瘤經刺激生長與未經刺激生長。通過採血分析,研究人員發現兩種模型小鼠血液內的CTCs數量隨時間增加而增加,且經刺激的小鼠血液內CTCs比未經刺激的更多。此外,經刺激的小鼠血液內CTCs的顯型會持續變化,而未經刺激的則趨於穩定。
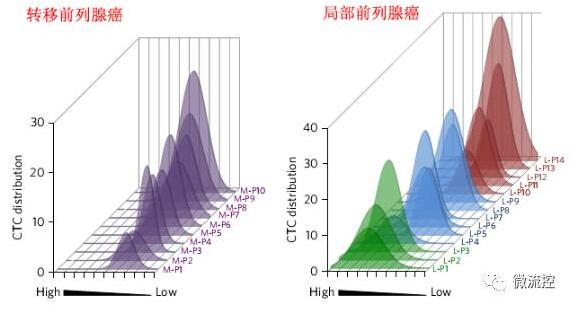
MagRC技術對臨床樣品CTCs的檢測與分類
最後,研究人員採用MagRC技術對患有轉移前列腺癌與局部前列腺癌病人血液內的CTCs進行檢測與分類。研究結果表明,相比於患有轉移前列腺癌的病人,患有局部前列腺癌病人血液內CTCs的顯型呈現出更大的多樣性。
Source:多倫多大學



 留言列表
留言列表